SA. Газовые законы
Изопроцессы в идеальном газе
Для описания состояния газа достаточно задать три макроскопических параметра — объем V, давление p и температуру T. Изменение одного из этих параметров вызывает изменение остальных. Если одновременно меняются объем, давление и температура, то на опыте трудно установить какие-либо закономерности. Проще сначала рассмотреть газ неизменной массы (m = const), зафиксировать значение одного из макропараметров (V, p или T) и рассмотреть изменение при этом двух других.
Процессы, при которых один из параметров p, V или Τ остается постоянным при данной массе газа, называют изопроцессами.
- isos в переводе с греческого означает «равный».
Законы, описывающие изопроцессы в идеальном газе, были открыты экспериментально.
Изотермический процесс
Изотермический процесс — это изопроцесс, происходящий при постоянной температуре: Τ = const.
- therme — тепло.
Закон экспериментально открыли независимо друг от друга английский химик и физик Роберт Бойль (1662) и французский физик Эдм Мариотт (1676).
Закон изотермического процесса (Бойля-Мариотта): для данной массы газа при постоянной температуре произведение давления на объем есть величина постоянная:
Для осуществления изотермического процесса надо сосуд, наполненный газом, привести в контакт с термостатом.
- Термостат — это прибор для поддержания постоянной температуры. Подробнее см. wikipedia
- Изотермическим процессом приближенно можно считать процесс медленного сжатия или расширения газа в сосуде с поршнем. Термостатом в этом случае служит окружающая среда.
Изобарный процесс
Изобарный процесс — это изопроцесс, происходящий при постоянном давлении: p = const.
- baros — тяжесть, вес.
Закон экспериментально исследовали независимо друг от друга французские физики Жак Шарль (1787) и Жозеф Гей-Люссак (1802).
- Работа Ж. Шарля была опубликована уже после открытия Ж. Гей-Люссака. Но изобарный процесс в российских учебниках называют законом Гей-Люссака, в белорусских — законом Шарля.
Закон изобарного процесса: при данной массе газа при постоянном давлении отношение объема к абсолютной температуре есть величина постоянная:
Этот закон можно записать через температуру t, измеряемую по шкале Цельсия\[~V = V_0 \cdot (1 + \alpha \cdot t),\] где V0 — объем газа при 0 °С, α = 1/273 К-1 — температурный коэффициент объемного расширения.
- Опыт показывает, что при малых плотностях температурный коэффициент объемного расширения не зависит от вида газа, т.е. одинаков для всех газов).
Получить изобарный процесс можно при помощи цилиндра с невесомым поршнем.
Изохорный процесс
Изохорный процесс — это изопроцесс, происходящий при постоянном объеме: V = const.
- chora — занимаемое место, объем.
Закон экспериментально исследовали независимо друг от друга французские физики Жак Шарль (1787) и Жозеф Гей-Люссак (1802).
- Изохорный процесс в российских учебниках называют законом Шарля, в белорусских — законом Гей-Люссака.
Закон изохорного процесса: при данной массе газа при постоянном объеме отношение давления к абсолютной температуре есть величина постоянная:
Если температуру измерять по шкале Цельсия, то закон Гей-Люссака запишется в виде\[~p = p_0 \cdot (1 + \alpha \cdot t),\] где p0 — давление газа при 0 °С, α — температурный коэффициент давления, оказавшийся одинаковым для всех газов: α = 1/273 К-1 .
Получить изохорный процесс можно в баллоне, который не изменяет свой объем при данном изменении температуры.
Тщательная экспериментальная проверка современными методами показала, что уравнение состояния идеального газа и вытекающие из него законы Бойля-Мариотта, Гей-Люссака и Шарля достаточно точно описывают поведение реальных газов при небольших давлениях и не слишком низких температурах.
Немного математики
График функции y(x), где a, b и с — постоянные величины:
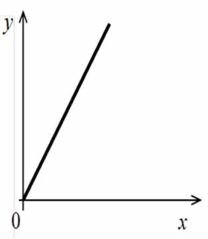
- y = a⋅x — прямая линия, проходящая через начало координат (рис. 1, а);
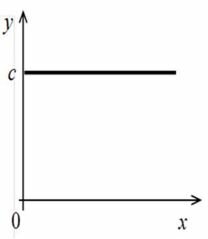
- y = c — прямая, перпендикулярная оси y и проходящая через точку c координатой y = c (рис. 1, б);
- \(~y = \dfrac{b}{x} \) — гипербола (рис. 1, в).
Графики изопроцессов
Так как мы рассматриваем три макропараметра p, T и V, то возможно три системы координат: (p, V), (V, Τ), (p, Т).
Графики зависимости между параметрами данной массы при постоянной температуре называются изотермами.
Рассмотрим два изотермических процесса с температурами T1 и T2 (T2 > T1). В координатах, где есть ось температуры ((V, Τ) и (p, Т)), графиками будут прямые, перпендикулярные оси T, и проходящие через точки T1 и T2 (рис. 2, а, б).
Определим вид графика в осях (p, V). Для изотермического процесса \(~p \cdot V = \operatorname{const}\). Обозначим эту константу буквой z1. Тогда
График этой функции — гипербола (рис. 2, в).
Графики зависимости между параметрами газа при постоянной массе газа и давлении называют изобарами.
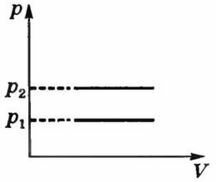
Рассмотрим два изобарных процесса с давлениями p1 и p2 (p2 > p1). В координатах, где есть ось давления ((p, Τ) и (p, V)), графиками будут прямые, перпендикулярные оси p, и проходящие через точки p1 и p2 (рис. 3, а, б).
Определим вид графика в осях (V, T). Для изобарного процесса \(~\dfrac{V}{T} = \operatorname{const}\). Обозначим эту константу буквой z2. Тогда
График этой функции — прямая линия, проходящая через начало координат (рис. 3, в).
Графики зависимости между параметрами газа при постоянной массе газа и постоянном объеме называют изохорами.
Рассмотрим два изохорных процесса с объемами V1 и V2 (V2 > V1). В координатах, где есть ось объема ((V, Τ) и (p, V)), графиками будут прямые, перпендикулярные оси V, и проходящие через точки V1 и V2 (рис. 4, а, б).
Определим вид графика в осях (p, T). Для изохорного процесса \(~\dfrac{p}{T} = \operatorname{const}\). Обозначим эту константу буквой z3. Тогда
График этой функции — прямая линия, проходящая через начало координат (рис. 4, в).
- Все графики изопроцессов прямые линии (исключение, гипербола в осях p(V)). Эти прямые проходят или через нуль, или перпендикулярно одной из осей.
- Так как давление газа, его объем и температура не могут равняться нулю, то при приближении к нулевым значениям линии графика изображают пунктирными линиями.
Уравнение состояния идеального газа
В изопроцессах два параметра изменялись при постоянном значении третьего. Но возможны случаи, когда меняются сразу три параметра. Например, когда нагретый у поверхности Земли воздух поднимается вверх, то он расширяется, давление его уменьшается и температура понижается.
Уравнение, связывающее температуру T, давление p и объем V для данной массы идеального газа , называют уравнением состояния газа.
Это уравнение было получено экспериментально, но его можно вывести из основного уравнения MKT:
По определению концентрация газа
где N — число молекул. Тогда
При неизменной массе газа число молекул в нем постоянно и произведение \(~k \cdot N = \operatorname{const}.\) Следовательно,
Соотношение (2) и есть уравнение состояния идеального газа. Его называют уравнением Клапейрона. Им пользуются в тех случаях, когда масса газа и его химический состав не изменяются и нужно сравнить два состояния газа.
Уравнение Клапейрона-Менделеева
В уравнении (1) число молекул N можно выразить через постоянную Авогадро \(~N = \dfrac mM \cdot N_A\), где m — масса газа, Μ — его молярная масса. Тогда получаем \(~\dfrac{p \cdot V}{T} = \dfrac mM \cdot k \cdot N_A \Rightarrow\)
Здесь \(~R = k \cdot N_A\) — универсальная газовая постоянная, равная
Уравнение (3) — это тоже уравнение состояния идеального газа. В такой форме оно было впервые записано русским ученым Д.И.Менделеевым, поэтому его называют уравнением Клапейрона-Менделеева. Оно справедливо для любой массы газа и связывает между собой параметры одного состояния газа.
Законы Авогадро и Дальтона
Из уравнения состояния вытекают два следствия:
- Из формулы (1) получим \(~N = \dfrac{p \cdot V}{k \cdot T}\), откуда видно, что если различные газы занимают при одинаковых температурах и одинаковых давлениях равные объемы, то число N молекул у них тоже одинаково, т.е. вытекает установленный опытным путем закон Авогадро: при равных давлениях и температурах в одинаковых объемах любых газов содержится одинаковое число молекул.
- Пусть в сосуде имеется смесь газов, каждый из которых при отсутствии других оказывает соответственно давление p1, p2, ... (парциальные давления газов). Запишем для каждого газа уравнение состояния:
\(~p_1 \cdot V = N_1 \cdot k\cdot T, p_2 \cdot V = N_2 \cdot k \cdot T, \ldots\)
и сложим их:
\(~p_1+ p_2 + \ldots = \dfrac{(N_1+ N_2 + \ldots) \cdot k \cdot T}{V} = \dfrac{N \cdot k \cdot T}{V},\)
где N1 + N2 + ... = N — число молекул смеси газов. Но \(~\dfrac{N \cdot k \cdot T}{V} = p\) .
Следовательно, p = p1 + p2 + ..., т.е давление смеси газов равно сумме парциальных давлений каждого из газов — это закон Дальтона, открытый им в 1801 г. экспериментально.
Литература
Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 143-146.