Referat. Ядро атома
Содержание
Ядро атома
После создания ядерной модели атома вопрос о составе атомного ядра стал одним из основных в ядерной физике. Из чего состоит атомное ядро? Какие силы удерживают составные части ядра друг возле друга? Ответы на эти вопросы физика ядра смогла дать только после накопления сведений о различных свойствах ядер.
Одна из основных характеристик атомного ядра — его электрический заряд. Точные измерения электрического заряда атомных ядер были выполнены в 1913 году Г. Мозли.
- Заряды ядер атомов различных химических элементов он определял по спектрам рентгеновского излучения, испускаемого атомами при облучении вещества потоком электронов высокой энергии.
Электрический заряд ядра атома q равен произведению элементарного электрического заряда е на порядковый номер Z химического элемента в таблице Д.И. Менделеева: q = Z·e.
Таким образом, зная порядковый номер химического элемента в таблице Д.И. Менделеева, мы можем определить число положительных зарядов в ядре любого атома химического элемента. В связи с этим порядковый номер элемента называется зарядовым числом (Z). И наоборот, зная зарядовое число, мы можем определить по таблице Д.И. Менделеева химический элемент.
Массы атомных ядер можно определить при помощи масс-спектрографа. Эту массу принято обозначать буквой М. Целое число, ближайшее к численному значению массы ядра, выраженному в атомных единицах массы (а.е.м.), называется массовым числом и обозначается буквой А. Массовое число — безразмерная величина.
Изучение рассеивания α-частиц и других видов излучений на ядрах атомов различных химических элементов показали, что многие атомные ядра имеют форму, близкую к сферической. Радиус атомного ядра определяется приближенной формулой: R = r0·A1/3, где r0 = 1,3·10-15 м, А — массовое число.
Зная массу ядер и их размеры, можно рассчитать их плотность. Для ядерного вещества она оказалась равной примерно 1,8·1017 кг/м3.
Открытия протона и нейтрона
Первую частицу, входящую в состав атомных ядер, открыл в 1919 г. Э. Резерфорд, исследуя взаимодействие α-частиц с ядрами атомов азота.
- В герметический сосуд помещался источник α-частиц, перед которым располагался прозрачный экран, покрытый сульфидом цинка. При выкачивании воздуха из сосуда, α-частицы достигали экрана и вызывали световые вспышки, наблюдаемые с помощью микроскопа. Источник частиц отодвинули от экрана настолько, что вспышек на экране не было видно, т.е. α-частицы не долетали до экрана. При заполнении сосуда газообразным азотом, на экране наблюдались световые вспышки. Так как электроны не способны вызвать световую вспышку, видимую в микроскоп, то следовательно, α-частицы из ядер азота выбивали какие-то другие заряженные частицы.
Исследования действия электрических и магнитных полей на частицы, выбиваемые из ядер азота, показали, что эти частицы обладают положительным элементарным зарядом и масса их равна массе ядра водорода. Эти частицы — ядра атомов водорода — назвали протонами. Обозначим протон \(~^1_1H\) или \(~^1_1p\) , тогда данную реакцию можно записать так\[~^{14}_7N + ^4_2He \rightarrow ^{17}_8O + ^1_1H\]. Продолжая опыты с бором, фтором, натрием и рядом других элементов, Э Резерфорд обнаружил, что α-частица выбивает и из этих ядер протоны. На этом основании можно сделать вывод, что ядра атомов всех элементов содержат протоны.
В 1930 г. немецкие ученые В. Боте и Г. Беккер обнаружили, что при облучении бериллия α-частицами, возникает излучение неизвестной природы, способное проходить через толстые слои свинца с меньшим ослаблением, чем даже рентгеновское или γ-излучение. Боте и Беккер решили, что они получили очень жесткие γ-лучи.
В 1932 г. французские ученые Ф. и И. Жолио-Кюри решили изучить излучение, получаемое при облучении бериллия α-частицами. Прежде всего они выяснили, что эти лучи почти не ионизуют воздух, через который проходят. Но если на их пути поместить парафин, то ионизирующая способность лучей резко возрастает. Они предположили, что это излучение выбивает из парафиновой пластины протоны, имеющиеся в большом количестве в этом водородосодержащем веществе.
В том же 1932 году, английский физик Д. Чедвик (сотрудник Э. Резерфорда) выдвинул предположение, согласно которому при облучении бериллия α-частицами излучаются не γ-лучи, а поток нейтральных частиц с массой, примерно равной массе протона. Гипотезу о существовании такой нейтральной частицы с массой, примерно равной массе протона, еще в 1920 г. высказал Резерфорд, он же и дал название предполагаемой частице — нейтрон .
- Название нейтрон произошло от лат. neutron — ни тот, ни другой, т.е. не имеющий ни положительного, ни отрицательного заряда.
Обозначается нейтрон \(~^1_0n\) . Опыты Чедвика явились экспериментальным доказательством существования нейтронов.
Состав ядра атома
После открытия нейтрона физики Д. Д. Иваненко (советский ученый) и В. Гейзенберг (немецкий ученый) в 1932 г. выдвинули гипотезу о протонно-нейтронной модели атомного ядра. Согласно этой модели ядро атома любого вещества состоит из протонов и нейтронов. (Общее название протонов и нейтронов — нуклоны.) Число протонов равно заряду ядра и совпадает с номером элемента в таблице Менделеева, т.е. Np = Z. Сумма числа протонов и нейтронов равна массовому числу, тогда число нейтронов Nn = A – Z. Например, ядро атома кислорода \(~^{16}_8O\) состоит из 8 протонов и 16 – 8 = 8 нейтронов. Ядро атома \(~^{235}_{92}U\) состоит из 92 протонов и 235 – 92 = 143 нейтронов.
Обозначаются нейтральный атом и его ядро одним и тем же символом элемента \(~^A_ZX\) , где Х — обозначение химического элемента; Z — порядковый номер элемента в периодической таблице Д.И. Менделеева или зарядовое число; А — массовое число, равное округленной до целого числа массе атома, выраженной в а.е.м.
Если проследить за распределением числа протонов и нейтронов в ядрах различных элементов периодической таблицы Д.И. Менделеева, то можно заметить, что для ядер элементов вплоть до середины таблицы число нейтронов примерно равно числу протонов, т.е. \(~\frac{N_n}{N_p} \approx 1\). По мере утяжеления ядер, количество нейтронов возрастает и в конце таблицы \(~\frac{N_n}{N_p} \approx 1,6\).
Изотопы
Изучения атомных ядер показали, что большинство химических элементов представляют собой смесь атомов с одинаковым зарядовым числом, но с различными массами. Атомы с одинаковыми зарядами ядра, но с различными массами назвали изотопами элемента.
- Название изотоп произошло от греч. isos — одинаковый, topos — место, т.е. это химические вещества, занимающие одно и то же место в таблице Д.И. Менделеева.
Ядра изотопов отличаются числом нейтронов. Например, водород имеет три изотопа: протий \(~^1_1H\) — ядро состоит из одного протона, дейтерий \(~^2_1H\) — ядро состоит из одного протона и одного нейтрона, тритий \(~^3_1H\) — ядро состоит из одного протона и двух нейтронов. Уран \(~_{92}U\) имеет 12 изотопов с массовыми числами от 228 до 239. Изотопы имеются у всех химических элементов, кроме техниция \(~^{99}_{43}Tc\) и прометия \(~^{141}_{61}Pm\) . В настоящее время известно боле 1900 изотопов. Химические элементы, существующие в природе, представляют собой смеси изотопов. Поэтому атомная масса химического элемента представляет собой среднее значение атомных масс всех его изотопов. Например, у хлора два изотопа с атомными массами 35 и 37, относительное содержание которых 75 и 25%. Поэтому среднее значение атомной массы элемента хлора равно (35·0,75) + (37·0,25) ≈ 35,5.
Ядерные силы
Открытие частиц, из которых состоит атомное ядро, поставило новую проблему — выяснить природу сил, связывающих частицы в атомном ядре.
К началу 20-го столетия физикам были известны лишь два типа сил: гравитационные и электромагнитные. Между одноименно заряженными протонами в атомном ядре действуют электростатические силы отталкивания, которые из-за малого расстояния между протонами, достигают колоссальных значений. Так в ядрах, состоящих из нескольких десятков протонов, силы кулоновского отталкивания достигают несколько тысяч ньютонов (а если учесть при этом массу протонов …). Можно было бы предположить, что кулоновскому отталкиванию протонов противодействует их гравитационное притяжение. Но расчеты показали, что сила гравитационного притяжения между протонами в ядре в 1036 раз меньше силы кулоновского отталкивания. Факт существования устойчивых атомных ядер свидетельствует о действии внутри атомных ядер новых сил притяжения. Их назвали ядерными силами.
Свойства ядерных сил к настоящему времени изучены экспериментально довольно хорошо. Можно выделить следующие особенности ядерных сил.
- Это самые мощные силы из всех, которыми располагает природа, так на расстоянии 10-15 м от центра протона ядерные силы примерно в 35 раз больше кулоновских и в 1038 раз больше гравитационных. Поэтому взаимодействие ядерных частиц часто называют сильными взаимодействиями.
- Это короткодействующие силы: они действуют на расстояниях между нуклонами, равными около 10-15 м и резко убывают при увеличении расстояния, так например, при расстоянии 1,4·10-15 м они уже практически равны 0.
- Это силы притяжения, но при сближении нуклонов до расстояний 0,5·10-15 м они становятся силами отталкивания.
- Ядерным силам свойственно насыщение. Это значит, что ядерные силы могут удерживать друг возле друга в ядре не любое количество нуклонов, а лишь определенное их число. Например, в ядре урана \(~^{235}_{92}U\) содержится 92 протона и 143 нейтрона. Все они удерживаются ядерными силами. Однако если в ядро урана попадает еще один нейтрон, оно становится неустойчивым и делится на две части. Следовательно, одновременно удержать 92 протона и 144 нейтрона ядерные силы уже не могут.
- Ядерные силы зарядовонезависимы, т.е. с одинаковой по модулю силой притягиваются друг к другу и заряженные, и незаряженные частицы.
- Ядерные силы являются обменными силами, т.е. нуклоны связыва-ются между собой третьей элементарной частицей (π-мезонами), которой они постоянно обмениваются. Взаимодействие между однородными нуклонами осуществляется нейтральными π0-мезонами; а взаимодействие между различными нуклонами — заряженными π-мезонами.
Энергия связи
Точные измерения масс атомных ядер с помощью масс-спектрографа показали, что масса любого ядра меньше суммы масс свободных протонов и нейтронов из которых это ядро состоит. Следовательно, существует разность масс между массой ядра и суммой масс протонов и нейтронов, называемая дефектом массы: Δm = Np·mp + Nn·mn – mядра .
Поэтому из закона взаимосвязи массы и энергии (Е = m·c2), следует, что сумма энергий свободных протонов и нейтронов больше энергии составленного из них ядра. Минимальная энергия, которую нужно затратить, для разделения атомного ядра на составляющие его нуклоны, называется энергией связи ядра и равна Есв = Δm·c2. Эта энергия расходуется на совершения работы против действия ядерных сил притяжения между нуклонами.
При образовании ядра из нуклонов последние за счет действия ядерных сил на малых расстояниях устремляются друг к другу с огромными ускорениями. Излучаемые при этом γ-кванты обладают энергией связи Есв и массой Δm = Есв/c2 , т.е. при соединении протонов и нейтронов в атомное ядро за счет работы сил ядерного притяжения выделяется энергия, равная по модулю энергии связи ядра. Об этой величине можно судить по такому примеру: образование 4 г гелия сопровождается выделением такой же энергии, как при сгорании 5-6 вагонов каменного угля.
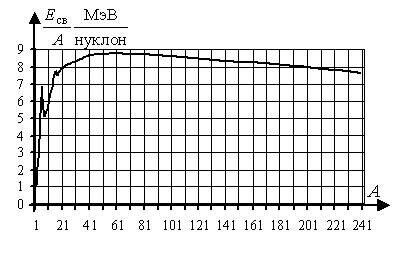
Важной характеристикой ядра служит средняя энергия связи ядра, приходящаяся на один нуклон — удельная энергия связи ядра (Есв/A) . Чем она больше, тем сильнее связаны между собой нуклоны, тем прочнее ядро. Зная удельные энергии ядер и их число нуклонов, легко можно подсчитать удельную энергию связи. Результаты показывают, что для большинства ядер Есв/A ≈ 8 МэВ/нуклон и уменьшается для очень легких и очень тяжелых ядер.
- У легких ядер большая доля нуклонов находится на поверхности ядра, где они не полностью используют свои связи и величина удельной энергии связи невелика. По мере увеличения массы ядра увеличивается радиус ядра (так как R = r0·A1/3), поэтому отношение площади поверхности к числу нуклонов уменьшается (так как S ~ R2, а A ~ R3, то \(~\frac{S}{A} \sim \frac{1}{R}\)), а значит уменьшается доля нуклонов, находящихся на поверхности, и удельная энергия связи растет. Однако по мере увеличения числа нуклонов в ядре возрастают кулоновские силы отталкивания между протонами, ослабляющими связи в ядре, и величина удельной энергии связи у тяжелых ядер уменьшается.
Зависимость удельной энергии связи нуклона в ядре (Есв/A) от массового числа (А) представлена графически на рисунке. Удельная энергия связи нуклонов в ядре в сотни тысяч раз превосходит энергию связи электронов в атомах.
Таким образом удельная энергия связи максимальна у ядер средней массы (А = 50 … 60), следовательно, они отличаются наибольшей прочностью. Отсюда следует важный вывод. В реакциях деления тяжелых ядер на два средних ядра и синтеза средних ядер из двух более легких ядер получаются ядра прочнее исходных, поэтому, при таких реакциях освобождается энергия.
Литература
- Аксенович Л.А., Ракина Н.Н. Физика. Оптика, атом и ядро. — Мн.: ДизайнПРО, 1997. — с. 162-167.
- Луцевич А.А., Яковенко С.В. Физика: Учеб. пособие. — Мн.: Выш. шк., 2000. — с. 420-428.
- Физика: Учеб. пособие для 11 кл. шк. и классов с углубл. изуч. физики/Под ред. А.А. Пинского. — М.: Просвещение, 1995. — с. 324-333.
- Шахмаев Н.М. и др. Физика: Учеб. пособие для 11 кл. сред. шк. — М.: Просвещение, 1991. — с. 185-191.