Kvant. Первый источник тока
Кикоин А.К. Первый источник электрического тока //Квант. — 1986. — № 1. — С. 25-27.
По специальной договоренности с редколлегией и редакцией журнала "Квант"
Электрический ток даже в простейшей электрической цепи может показаться несколько загадочным явлением. В самом деле, ток — это упорядоченное движение электрических зарядов, например электронов в металлическом проводнике. Упорядоченно двигаться их заставляет электрическое поле. Но, как известно, работа электростатического поля по замкнутой траектории равна нулю (а электрические цепи, в которых протекает постоянный электрический ток, всегда замкнуты). Тем не менее в цепи при прохождении тока совершается работа. За счет этой работы, например, нагреваются проводники.
Почему же в цепи существует электрический ток и почему при его прохождении совершается работа?
И то и другое возможно только потому, что где-то в цепи действуют какие-то неэлектростатические силы, которые могут создать и поддерживать в цепи электростатическое поле и работа которых не равна нулю. Силы эти получили название сторонних сил. То место в цепи, где они действуют, носит название (не совсем удачное) источника тока.
Что это за сторонние силы и как они действуют? В качестве примера рассмотрим первый в истории химический источник постоянного тока. Его придумал в самом конце XVIII века итальянский физик Алессандро Вольта (1745-1827). Теперь этот источник называют элементом Вольта. Он состоит из цинкового и медного электродов, погруженных в раствор серной кислоты.
Заметим, что медь и цинк состоят не из нейтральных атомов, а из положительных ионов соответствующего металла и электронов, оторвавшихся от атомов и ставших, как говорят, свободными. Следует иметь в виду, что и раствор кислоты состоит не из нейтральных молекул воды (Н2О) и серной кислоты (Н2SO4). Значительная часть молекул Н2SO4 в воде превращается в три иона — два положительно заряженных иона водорода Н+ и отрицательно заряженный ион SO42- с двойным зарядом:
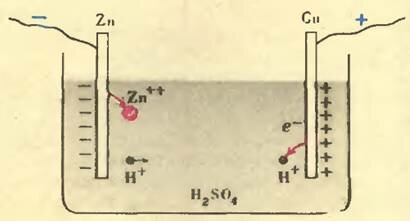
Посмотрим, что происходит, когда в такой раствор погружают электроды (см. рисунок). Начнем с цинка.
При погружении цинка в раствор кислоты начинается химическая реакция взаимодействия ионов SO42- и Zn2+, в результате чего ионы цинка отрываются от электрода и переходят в раствор. При этом на электроде оказывается избыток электронов, и он становится отрицательно заряженным. По мере накопления ионов Zn2+ в растворе некоторая их часть, притягиваемая электродом, возвращается обратно. В конце концов устанавливается динамическое равновесие: число ионов, покидающих цинк, равно числу ионов, возвращающихся в него. Но электрод остается заряженным отрицательно, а раствор вблизи электрода (за счет ионов цинка) получает положительный заряд.
Появление дополнительных положительных ионов около цинкового электрода вызывает перераспределение уже имеющихся ионов внутри раствора. Часть отрицательных ионов из соседнего слоя перемещается ближе к электроду, а часть положительных ионов оттесняется в более удаленный слой. Подобные перемещения происходят во всех слоях раствора, вплоть до слоя, прилегающего к медному электроду. Здесь происходит следующий процесс.
В отличие от цинка медь почти не растворяется в кислоте, то есть не посылает в раствор своих ионов. Наоборот, положительные ионы водорода из раствора, попадая на медный электрод, отбирают у него свободные электроны и нейтрализуются. Медь становится положительно заряженной, а раствор около нее приобретает отрицательный заряд.
Таким образом, медный электрод в элементе Вольта образует положительный полюс, а цинковый электрод — отрицательный. Разность потенциалов между ними составляет приблизительно 1,1 В.
Посмотрим теперь, что произойдет, если электроды соединить металлическим проводником. Свободные электроны во внешней части цепи (в проводнике) начнут двигаться от цинка, где они имеются в избытке, к меди, где их недостает. Это означает, что во внешней части цепи возникнет электрический ток, направленный от меди к цинку.
А что же в самом элементе Вольта? Из-за ухода электронов с цинка равновесие между цинковым электродом и раствором нарушается, в результате чего дополнительное число ионов цинка будет переходить в раствор, поддерживая тем самым отрицательный заряд электрода. А из-за прихода электронов на медный электрод большее число положительных ионов водорода из раствора сможет нейтрализоваться на этом электроде. При этом положительный заряд меди тоже будет поддерживаться.
Мы видим, таким образом, что в то время, как во внешней части цепи от цинкового электрода к медному движутся свободные электроны, внутри источника движутся ионы: положительные от цинка к меди и отрицательные от меди к цинку. Так в замкнутой цепи осуществляется непрерывный круговой процесс перемещения электрических зарядов, то есть электрический ток.
Какие же силы совершают работу по поддержанию постоянной разности потенциалов между медным и цинковым электродами? Это так называемые химические силы, действующие внутри элемента Вольта. Другими словами можно сказать, что источником энергии электрического тока служит энергия, выделяющаяся при химических реакциях между электродами и раствором кислоты.
Отсюда получается, что «источник тока» в действительности есть источник энергии, за счет которой и совершается работа по перемещению зарядов по цепи, проявляющаяся, в частности, в нагреве проводников. Энергию, приходящуюся на единицу заряда, обходящего цепь, называют электродвижущей силой источника. В других источниках происходят другие процессы, действуют другие силы, но роль их всегда такая же как и в рассмотренном нами элементе Вольта.